هیدئو کوداما، از موسسه تحقیقات صنعتی شهرداری ناگویا، برای نخستین بار تجهیزات پرینت سه بعدی را تولید کرد و آن را گسترش داد. همچنین دو روش جدید را برای ساختن مدلهای سه بعدی اختراع کرد. هیدئو کوداما با توجه به کاری که رالف بیکر در دهه 1920 برای ساخت محصولات تزئینی کرد، نمونهسازی رزین با لیزر را در سال 1981 تکمیل کرد. در سال 1987 نیز چاک هال اولین چاپگر سه بعدی را به وسیله سیستمهای سه بعدی اختراع کرد. برای شناخت بیشتر این فناوری لازم است از انواع روشهای پرینت سه بعدی و مزیتها و محدودیتهای هر کدام از آنها آگاهی کافی داشته باشیم. امروزه حدود ۲۵ تکنیک برای پرینت سه بعدی در دنیا وجود دارد که بعضی از آنها تجاری شدهاند و میتوان گفت حدود ۱۰ مورد از آنها در بازار و و صنعت قطعهسازی و نمونهسازی به صورت رایج وجود دارد. در این مقاله درباره اصول دستهبندی و نام گذاری انواع روشهای پرینت سه بعدی توضیح داده خواهد شد. در این مقاله میخواهیم به هر کدام از انواع روشهای پرینت سه بعدی که برای ارائه خدمات پرینتر ۳ بعدی متنوع هستند، به صورت اختصاصی بپردازیم. انواع مواد مصرفی پرینت سه بعدی از جمله ترموپلاستیکها مانند اکریلونیتریل بوتادین استایرن (ABS)، SLS، FDM، LOM، Printing (BinderJetting)، DDM، Polyjet، DLP و FusionJet و ...، فلزات در دسترساند. در این مقاله قصد داریم پس از ذکر توضیحاتی درمورد تکنولوژی پرینترهای سه بعدی، انواع فیلامنتهای استفاده شده در آنها و مواد مصرفی در پرینترهای سه بعدی را نیز توضیح دهیم.
فناوریهای چاپ سه بعدی

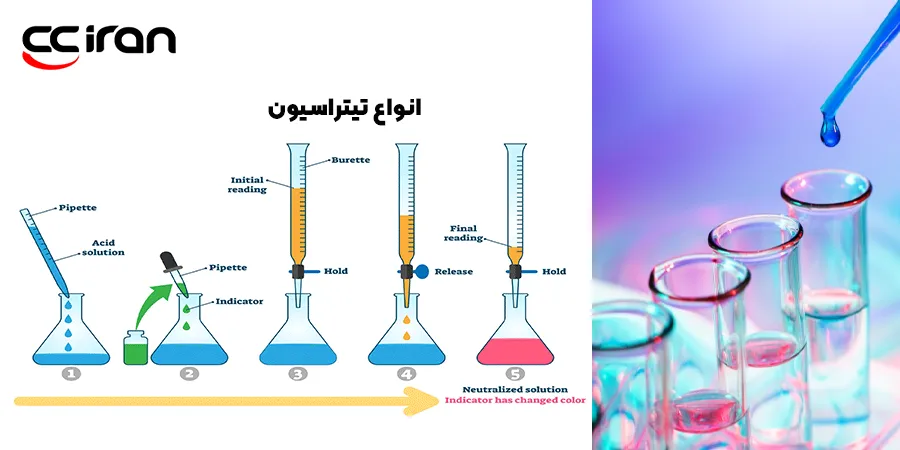
فناوریهای چاپ سه بعدی در سه دسته عمده تقسیم میشوند که در ادامه به بررسی هر کدام از آنها میپردازیم. این فناوریها عبارتاند از:
1. تف جوشی لیزری
مواد در این نوع فناوری برای ایجاد اقلام با وضوح بالا گرم میشوند؛ اما به نقطه ذوب نمیرسند. این فناوری به 2 دسته تف جوش لیزری مستقیم و انتخابی تقسیم میشود. تف جوشی لیزری مستقیم که نام دیگر آن DMLS میباشد متعلق به دستهی همجوشی بستر پودری (PBF) پرینت سه بعدی بوده و شبیه به فناوری تف جوشی لیزری انتخابی( SLS) است اما تفاوتهایی هم دارند. برای تف جوشی لیزری انتخابی پودر ترموپلاستیک کاربرد دارد. اما در DMLS به جای پودرهای پلاستیکی، از پودرهای فلزی برای ایجاد قطعات فلزی استفاده میشود که هم برای نمونههای اولیهی کاربردی و هم برای قطعات تولیدی قابل استفاده است. دمای مورد استفاده برای همجوشی پودر فلزات در این دو فرآیند متفاوت است. در SLS پودر فلز تا زمانی که کاملا به مایع تبدیل گردد، گرم میشود. DMLS پودر فلز را ذوب نمیکند؛ بلکه ذرات را به اندازه کافی حرارت میدهد تا سطوح آنها به یکدیگر جوش بخورند. به هر حال، هر دو اصطلاح (SLS و DMLS) اغلب به جای هم در صنعت پرینت سه بعدی استفاده میشوند.
روش کار DMLS
این فناوری شامل 6 مرحله میباشد که به ترتیب به شرح آنها خواهیم پرداخت:
- مرحله اول: آغاز این فرایند با برش دادههای فایل CAD طراحی سه بعدی به لایههای منفرد بسیار نازک و ایجاد یک مدل دو بعدی را برای هر لایه شروع می شود.
- مرحله دوم: این دستگاه از یک لیزر نوری پرقدرت در داخل محفظهی ساختی که حاوی گاز بیاثر است، بهره میبرد.
- مرحله سوم: برای جابجایی پودر جدید روی پلتفرم ساخت از یک پلتفرم توزیع مواد و یک پلتفرم ساخت همراه با یک غلتک به صورت لایه به لایه استفاده میشود.
- مرحله چهارم: لیزر مسیر خود را برای تولید این لایه با قرار گرفتن پودر روی پلتفرم ساخت آغاز میکند پودر را به یک جسم جامد به صورت انتخابی تف جوشی میکند. تا زمانی که کل قطعه کامل شود افزودن لایهی پودری و تف جوشی به همین صورت ادامه مییابد.
- مرحله پنجم: پس از خنک شدن، پودر فلز اضافی اطراف از پرینتر خارج میشود. مراحل نهایی شامل حذف سازههای پشتیبانی و سایر فرآیندهای پس پردازش است.
- مرحله ششم: از قطعات DMLS میتوان برای فرآوری بیشتر مانند قطعات فلزی تولید شده توسط فلزکاری معمولی استفاده نمود. این کار میتواند شامل ماشینکاری، عملیات حرارتی یا پرداخت سطح باشد.
مواد پرینت سه بعدی DMLS
به طور کلی از مواد زیر برای DMLS استفاده میشود:
- آلومینیوم: مانند AlSiMG
- فولاد: مانند فولاد ابزار MS1، فولاد ضدزنگ 17-4، فولاد ضدزنگ 316L
- اینکونل: مانند اینکونل 718
مزایای فناوری DMLS
- امکان اجرای طراحیهای پیچیده
- زمان ساخت سریع
- استفاده از اجزای سبک و بادوام
- امکان هدر رفت کمتر
پرینتر سه بعدی SLS

دستگاه پرینتر سه بعدی SLS از دستگاههایی است که به وسیله ماده اولیه پودری شکل به ساخت قطعه میپردازد، از این رو پودر پایه است. سیستمهای مختلفی در یک دستگاه SLS به همراه یکدیگر کار میکنند تا قطعه ساخته شود. قسمتهای اصلی دستگاه که میبایست در کنار هم کار کنند تا قطعه ساخته شود عبارتند از:
- سیستم اسکن لیزر
- سیستمهای حرارتی
- سیستم گردش گاز بی اثر
- سیستم تغذیه پودر
- سیستم پلاتفورم
- واحد کنترل (الکترونیک و نرمافزار)
در دستگاه SLS برای ساخت قطعه که اول باید فایل CAD قطعه مورد نظر به دستگاه شناسانده شود. برای این کار باید فایل CAD مورد نظر لایه لایه شود. ابتدا فایل CAD در جهت ترجیحی در دستگاه قرار میگیرد و از پایینترین قسمت قطعه موازی صفحه X-Y صفحاتی از قطعه عبور داده میشود و از محل تقاطع این صفحه با لبههای جسم مورد نظر کانتورهای بستهای به دست میآیند. سپس صفحه دیگری بالاتر از صفحه قبلی به اندازه ضخامت یک لایه با جسم قطع داده میشود و این کار تا جایی پیش میرود که به بالاترین قسمت جسم برسد. در پایان، تعداد زیادی کانتورهای بسته که نشان دهنده اطراف جسم هستند به دست میآیند. این کانتورها محل عبور لیزر را بر روی سطح پودر مشخص میکنند.
بعد از به دست آمدن کانتورها به ساخت فیزیکی قطعه پرداخته میشود. در این مرحله، ابتدا یک لایه پودر توسط مکانیزم لایه نشانی بر روی سطح پلاتفورم پخش میشود. ضخامت لایه میتواند متفاوت باشد اما معمولا عددی در حدود ۱۰۰ میکرون است که با کم و زیاد شدن آن، سرعت و دقت دستگاه کم و زیاد میشود. پس از پخش شدن پودر سطح آن توسط گرمکنهای تابشی دستگاه تا دمای مشخصی پیشگرم میشوند که این مخصوص دستگاه های SLS پلیمری است، در فرآیند SLS فلزی این پیشگرم به دلایل فنی مورد نیاز نیست.
سپس طرح مورد نظر توسط سیستم اسکن لیزر بر روی سطح پودر مارک میشود. این طرح از کانتورهای دور جسم منشا میگیرد. ذرات پودر در نقاط مارک شده به دلیل توان حرارتی لیزر به یکدیگر جوش میخورند و یک جسم جامد را تشکیل میدهند. سپس با تکرار این سیکل دوباره یک لایه دیگر از پودر بر روی لایه قبلی ریخته میشود و این فرآیند تا آخر و تا وقتی که قطعه کامل ساخته شود، ادامه پیدا میکند. در مارک کردن لایه بالایی باید توان لیزر به میزانی باشد که لایه فوقانی به لایه تحتانی جوش داده شود تا پیوستگی قطعه حفظ شود.
مزایای پرینتر سه بعدی SLS
- امکان تولید قطعات کاربردی و عملیاتی
- استحکام و ضربه پذیری بالای قطعات
- پایداری حرارتی و شیمیایی بالا
- زیست سازگاری و کاربرد در تولید گایدها و مدلهای جراحی، پروتز و اورتز و داربستهای مهندسی یافت.
- قابلیت ماشینکاری و پولیش و رنگ
- سرعت بالای تولید قطعات در تیراژ تولید تا ۵۰۰
- به صرفه در تولید تیراژ بالاتر نسبت به مابقی روشهای پرینت سه بعدی
محدودیتهای پرینتر سه بعدی SLS
- هزینه بالا برای کاربردهایی که نیاز به استحکام مکانیکی بالا ندارند
- دقت متوسط این روش نسبت به روشهای دقیقتر مثل روش DLP و PolyJet
- عدم توانایی تولید قطعات به صورت توخالی مانند روش FDM
2. ذوب

این روش پرینت سه بعدی، همجوشی بستر پودری، ذوب پرتو الکترون و رسوب مستقیم انرژی را در بر میگیرد. در روش ذوب لیزر، قوس الکتریکی یا پرتوهای الکترونی را به کار میگیرند و به وسیله آنها اشیا را چاپ میکنند. در این روش تمام مواد را با هم در دمای بالا ذوب میکنند.
ذوب پرتو الکترون پرینت سه بعدی، یک فرایند تولید سه بعدی است که در این روش یک پودر فلز توسط یک پرتو پر انرژی از الکترونها ذوب میشود. یعنی یک پرتو الکترون جریانی الکترون تولید کرده که توسط یک میدان مغناطیسی هدایت میشود و لایهای از فلز پودر شده ذوب شده و یک جسم مطابق با مشخصاتی که توسط یک مدل CAD به طور دقیق تعریف شده، ایجاد شود.
از نظر مکان تولید، تولید را باید در یک محفظه خلاء انجام داد تا از اکسیداسیون جلوگیری شود. زیرا اکسیداسیون میتواند مواد بسیار واکنشپذیر را به خطر بیاندازد. ذوب اشعه الکترون و ذوب لیزری انتخابی هر دو از یک پودر از بستر پرینتر سه بعدی چاپ میکنند و از این نظر به هم شباهت دارند اما EBM به جای لیزر از پرتو الکترونی استفاده میکند.
قطعاتی که EBM میسازد استحکام بالایی دارد که بیشترین استفاده را از خواص فلزات مورد استفاده در این فرآیند میبرد. و البته ناخالصیهایی را که هنگام استفاده از ریختهگری فلزات یا استفاده از سایر روشهای ساخت ممکن است جمع شود، حذف میکند.
فرآیند ذوب پرتو الکترون
برای این فرایند ابتدا باید قسمتی که می خواهیم ایجاد کنیم را مدلسازی سه بعدی کنیم. میتوان این مدلسازی را با استفاده از نرمافزار CAD انجام داد. میتوانیم آن را با اسکن سه بعدی بدست آوریم یا مدل دلخواه خود را بارگیری کنیم. سپس مدل سه بعدی به یک نرمافزار برش، ارسال میشود که اسلایسر نیز نامیده میشود. که با توجه به لایههای فیزیکی پی در پی مواد رسوب شده آن را برش میدهد.
سپس اسلایسر تمام این اطلاعات را مستقیماً به پرینتر سه بعدی ارسال میکند و روند تولید آغاز میشود. پودر فلزی را میتوان در مخزن داخل دستگاه بارگیری کرد، که در لایههای نازکی که قبل از جوش خوردن توسط پرتو الکترون گرم میشوند، رسوب میکند. دستگاه این مراحل را تا آنجا که لازم است برای ایجاد کل قطعه تکرار میکند.
بعد از اینکه فرآیند تولید به اتمام رسید، اپراتور قطعه را از دستگاه خارج کرده و پودر ذوب نشده را به وسیله یک تفنگ یا قلم مو خارج میکند. همینطور بهتر است اگر از پایههای چاپ استفاده کردهایم آنها را برداشته و قطعه را از صفحه ساخت جدا کنیم. مراحل بعد از چاپ شامل ماشینکاری سطوح در تماس با سایر قطعات، پرداخت و غیره هستند. بعضی مواقع لازم است برای آزاد شدن تنشهای ناشی از فرایند تولید قطعه را در کوره به مدت چند ساعت گرم کنیم.
توجه به این نکته ضروری است که کلیه مراحل تولید باید تحت خلاء انجام شود تا پرتو الکترون به درستی کار کند و همچنین از اکسید شدن پودر هنگام گرم شدن جلوگیری شود. در پایان فرآیند تولید، بخش بزرگی از پودر ذوب نشده مستقیما قابل استفاده مجدد است. به ویژه در بخش هوانوردی که اغلب اتفاق میافتد که تنها 20 درصد از مواد خریداری شده برای تولید قسمت نهایی استفاده میشود، بقیه با ماشینکاری حذف شده و برای بازیافت ارسال میشوند.
تفاوتهای لیزر و پرتو الکترون
این دو فرایند تفاوتهایی داشته و هر دو دارای مزایا و محدودیتهایی هستند که به شرح آنها خواهیم پرداخت.
نقاط قوت
سرعت تولید: از این نظر پرتو الکترونی ارجحیت دارد و میتواند پودر را در چندین مکان به طور همزمان گرم کند که به طور قابل توجهی سرعت تولید را افزایش دهد. اما از سوی دیگر، لیزر باید نقطه به نقطه سطح را اسکن کند.
نقاط ضعف
دقت: از این نظر لیزر ارجح است چون سطح پودر پرتو الکترونی، کمی گستردهتر از پرتو لیزر است که باعث کاهش دقت میشود.
اندازه قطعات قابل تولید: بزرگترین حجم ساخت (Arcam ) (در دستگاه Q20) نشان دهنده قطر 350 میلیمتر و ارتفاع 380 میلیمتر است. از سوی دیگر، دستگاههای لیزری (مانند X-Line of Concept Laser) حجم تولید را حداقل دو برابر بیشتر ارائه میدهند.
تفاوت بین ذوب اشعه الکترون (EBM) با ذوب لیزری انتخابی (SLM)
 and (SLM).webp)
از نظر ذوب شدن بهم شباهت دارند. زیرا هر دو از یک پودر از بستر پودر چاپگر سه بعدی چاپ میکنند، اما ( EBM) به جای فوتونهای مورد استفاده در فرایند (SLM ) از الکترونها استفاده میکند. در ( EBM)، پرتو الکترونی با انرژی بالا، لایههای فلز پودر را ذوب میکند تا در خلاء شکل ایجاد کند. در (SLM )، یک پرتو لیزر که فوتونها را ساطع میکند، به هم پیوسته یا لایههایی از فلزات پودر شده را برای سفت شدن فلز متصل میکند.
(SLM ) به محیط خلاء نیاز ندارد. فناوری ذوب پرتوهای الکترونیکی اختصاصی است و پرینترهای ( EBM) برای اجرای آنها به تکنسینهای ماهر نیاز دارند. ( EBM) میتواند بسیار سریعتر از (SLM ) (ذوب لیزری انتخابی) باشد، اما با این حال (SLM ) قطعات صاف و دقیقتری تولید میکند.
دمای مورد نیاز برای (EBM)
(EBM) اغلب در فلزات با نقطه ذوب بالا استفاده میشود به همین دلیل، در فرآیند ذوب پرتو الکترون دما حداکثر 2000 درجه سانتیگراد اندازهگیری شده است.
تصفیه فلزات در حرارت بالا باعث افزایش اکسیداسیون میشود و محصول نهایی را شکننده میکند. انجام شدن فرایند ( EBM) در خلاء و ایجاد دمای بالا در محیط بدون اکسیژن باعث از بین بردن تنشهای داخلی و در نتیجه ایجاد قطعات انعطافپذیری میشود.
تفنگ پرتو الکترونی
تفنگ پرتو الکترونی دارای رشتهای از تنگستن است که در صورت گرم شدن بیش از حد، جریانی از الکترونها را از خود ساطع میکند که در خلاء تقریباً به نصف سرعت نور میرسد.
جالب است بدانیم از آنجایی که (EBM) متکی به بارهای الکتریکی و دمای بسیار بالا است، میتوان آن را فقط در مواد رسانا مانند فلزات استفاده کرد.
کدام یک برای نمونهسازی سریع بهتر است: SLS یا EBM؟
پرتو الکترونی وسیعتر از پرتو لیزر است و به همین دلیل، ( EBM) ممکن است قطعه ای کمتر از (SLS ) تولید کند اما در تولید اجسام بزرگتر سریعتر است.
3.استریولیتوگرافی

استریولیتوگرافی یا SLA یکی از روشهای تولید افزایشی میباشد و به آن پرینت سه بعدی نیز گفته میشود. عملکرد آن به این گونه است که از طریق جامد کردن (curing) مواد حساس به نور مایع به صورت لایه به لایه و انتخابی طی عملیاتی به نام فوتوپلیمریزاسیون عمل میکند. در این روش با فوتوپلیمریزاسیون ایجاد قطعات امکان پذیر میشود. در فناوری استریولیتوگرافی از منبع نور استفاده میکنند تا مواد را با روشی انتخابی درمان و جامد کنند.
از استریولیتوگرافی به طور گستردهای برای تولید مدلها، نمونهسازی، الگوها و محصولات تولیدی محدودهی وسیعی از صنایع، از مهندسی و طراحی محصول گرفته تا صنعت، جواهر سازی، دندان پزشکی، ساخت نمونه و اموزش استفاده میشود.
اولین بار فرایند SLA در اوایل سال 1970 توسط یک محقق ژاپنی به نام هیدوکوداما (Dr. Hideo Kodama) پایهگذاری شد و توانست با استفاده از نور فرابنفش پلیمرهای حساس به نور را جامد کند و روش مدرن لایه به لایه استریولیتوگرافی را ابداع کند.
خود واژه استریلیتوگرافی توسط چارلز(Charles (Chuck) W. Hull) استفاده شد که توانسته بود این تکنولوژی را در سال 1986 تجاری سازی کند و به ثبت برساند.
انواع فیلامنتهایی که در پرینترهای سه بعدی استفاده میشوند

فیلامنت پرینت سه بعدی انواع خاصی از پلاستیک هستند که ترموپلاستیک نامیده میشوند ترموپلاستیکها اگر تا دمای مناسب گرم شوند انعطافپذیر میشوند و به همین دلیل میتوان برای تبدیل نوردها به محصول نهایی از فرآیند گرم کردن پلاستیک بهره جست. در پرینترها تعدادی رشته یا فیلامنت به چشم میخورد. این فیلامنتها روی یک قرقره چاپگر سه بعدی قرار میگیرند و یک اکسترودر آنها را از طریق نازل گرم شده هدایت میکند. سپس برای ساختن یک قطعه پرینت سه بعدی و لایه لایه از پلاستیک اکسترود شده استفاده میکنند. انواع فیلامنتها و مواد مصرفی در پرینترهای سه بعدی متفاوتاند. ما در این بخش تعدادی از آنها را مورد بررسی قرار میدهیم:
در میان فیلامنتها فیلامنت PLA پرکاربردترین و پرمصرف ترین مواد در پرینت سه بعدی به شمار میرود. فیلامنت پلی لاکتیک اسید (PLA) یک پلی استر ترموپلاستیک طبیعی و قابل بازیافت است که از منابع تجدیدپذیر مانند نشاسته ذرت یا نیشکر به دست میآید. این نوع فلامت یکی از محبوبترین متریالها در ساخت لوازم پلاستیکی، از ظروف یکبار مصرف گرفته تا ایمپلنتهای پزشکی است. فیلامنت PLA با توجه به خواص و ویژگیهایی که دارد امروزه به عنوان یکی از رایجترین مواد اولیه پرینتر سه بعدی مورد استفاده قرار میگیرد. ساخت مصنوعات با استفاده از PLA بسیار راحت بوده و قابل استفاده در انواع مختلفی از پرینترهای سه بعدی میباشد. در حال حاضر از این نوع فلامنت در صنایع به شکل گستردهای استفاده میشود. پلی لاکتیک اسید (PLA)، از منابع آلی ساخته شده است؛ در حالی که انواع دیگر فیلامنتهای پرینترهای سه بعدی از مواد نفتی ساخته میشوند. چاپ PLA بسیار آسان است و برای محیطزیست خطری محسوب نمیشود؛ اما از سوی دیگر بسیار شکننده است و در برابر اشعه ماوراء بنفش نمیتواند مقاومت کند. اصلیترین ماده تشکیل دهنده فیلامنت PLA لاکتیک اسید است. لاکتیک اسید یا هیدروکسی پروپیونیک اسید نوعی اسید آلی هیدروکسیلی ضعیف و با مولکولهای بسیار سبک میباشد. این ساختار، PLA را برای ساخت قطعات زیست تخریبپذیر با عمر 6 تا 12 ماه مناسب میسازد. اگرچه PLA در برابر گرما مقاومت کمی دارد و در معرض نور خورشید دچار انقباض میشود، اما استفاده از آن را در پرینتر سه بعدی سهولت میبخشد. فیلامنت PLA در دمای ۱۸۰ تا ۲۳۰ درجه سانتیگراد آماده استفاده در چاپگر سه بعدی است.
فیلامنت PLA به ذاتا شفاف و نیمه بلور است. همچنین دمای ذوب آن 190 تا 220 درجه سانتیگراد بوده که در مقایسه با دمای ذوب 210 تا 260 درجه سانتیگراد فیلامنت ABS بسیار پایینتر است. این به این معناست که به هنگام چاپ الزامی برای استفاده از بستر چاپ وجود ندارد. بزرگترین عیب فیلامنت PLA را گرانروی بالای آن است که باعث مسدود شدن نازل چاپ پرینتر سه بعدی میشود.
فیلامنت PLA متریالی بسیار مناسب برای کاربردهای مختلف است. اگرچه خصوصیات مکانیکی آن نسبت به سایر فیلامنتها کمی دلسرد کننده است، اما استفاده از آن در پرینتر سه بعدی به مراتب آسانتر است و تنوع رنگی بیشتری دارد. بنابراین از متریال PLA برای قطعاتی که تحت فشار یا کشش قرار نمیگیرند مانند نمونه سازی سریع و مدلسازی به وفور استفاده میشود.
فیلامنت PLA تنوع زیادی در رنگ و نوع دارد. این فیلامنت در رنگها و انواع گوناگونی عرضه میشود. برای مثال میتوان نمونههای طرح چوب، شفاف، شب رنگ و … را نام برد که شکلهای گوناگونی از همین فیلامنت هستند. البته برای این که این فیلامنت همچین ویژگیهایی را داشته باشد لازم است ترکیباتی به ماده اصلی اضافه شود که مواد اضافه شده، معمولا ناخالصی بیشتری را به فیلامت میدهند که میتواند منجر به گرفتگی نازل یا خرابی بلوک شود.
PLA نخستین بار در سال 1930 و توسط شیمیدان آمریکایی والاس کاروترز به جهان معرفی شد. اما در سال 1980 خواص و ویژگیهای PLA مورد توجه قرار گرفت و تولید انبوه آن توسط شرکت آمریکایی Cargill آغاز گردید. همانطور که در بالا اشاره نمودیم، این نوع پلیمر ترموپلاستیک با تخمیر کربوهیدرات نشاسته ذرت یا نیشکر تولید میشود. برای این کار با آسیاب کردن ذرت، نشاسته را جدا کرده و با مونومرهای اسیدی یا لاکتیکی مخلوط میکنند. با این کار قند موجود در نشاسته ذرت یا گلوکز D شکسته میشود. سپس با تخمیر گلوکز اسید، لاکتیک که ماده اصلی فیلامنت PLA است تشکیل میگردد.
انواع متریال PLA در مدلهای مختلف متفاوت میشود.
- رشتههای چوب :PLA با افزودن چوبهایی مانند سرو، بامبو، چوب پنبه، کاج و گردو به مواد اصلی فیلامنت PLA، میتوان ظاهری چوبی و طبیعی به محصول نهایی بخشید.
- رشتههای فلزی :PLA با ترکیب فلزاتی چون برنج، مس، برنز، فولاد، آهن و برنز علاوه بر افزایش مقاومت فیلامنت، میتوان محصولاتی با سطح براق و فلزی ساخت.
- انواع دیگر فیلامنت PLA: PLA در اشکال دیگری مانند کربن رسانا، فیبر کربن، قهوه برای عطر دار کردن فیلامنت نیز تولید میشود.
- فیلامنت رنگی: رشتههای PLA در طیف وسیعی از رنگها تولید میشوند.
ویژگیهای اصلی این فیلامنت عبارتاند از:
PLA در حین چاپ، به آسانی خمیده نمیشود.
این فیلامنت در آب حل نمیشود؛ اما حلال در استون، متیل اتیل کتون و سود سوزآور است.
- ساختار خشک و غیر منعطف
- سازگار و قابل استفاده در اکثر پرینترهای سه بعدی
- مقرون به صرفه
- تنوع بالا در تولیدکنندگان
- قابلیت پرداز و پولیش
- ساخت قطعات با سطحی صاف و متوازن
- پرینت سریعتر قطعات
معایب فیلامنت PLA
- مقاومت فیزیکی و انعطافپذیری کم
- آسیب پذیر در برابر حرارت
- مسدود شدن نازل: همانطور که اشاره نمودیم، برای ایجاد تنوع و ویژگیها و رنگهای متفاوت در فیلامنت PLA نیاز است که مواد مکملی به PLA افزوده شود. این مواد میزان ناخالصی PLA را افزایش میدهند. ناخالصی موجود در فیلامنت PLA احتمال مسدود شدن نازل و خرابی بلوک را افزایش میدهد.
- نیاز به فن خنک کننده: محصولاتی که با متریال PLA ساخته میشوند پس از اتمام فرایند چاپ باید با استفاده از فن خنک کننده سرد شوند.
برای آن که محصول نهایی از کیفیت بالایی برخوردار باشد باید به نکاتی توجه داشت که یکی از مهمترین این نکات، تنظیم حرارت پرینتر سه بعدی متناسب با متریال مورد استفاده است. زیرا دمای بالاتر از حد تحمل باعث میشود فرم قطعه بهم خورده و لایهها بر روی دیگر در حین پرینت تطابق نداشته باشند. بهترین دما برای استفاده از فیلامنت PLA در پرینتر سه بعدی 190 تا 220 درجه سانتیگراد است. به طور معمول بر روی قرقره فلامنت میزان مناسب دما درج شده است. استفاده از بستر گرم شونده یا Heated Bed برای اکثر فیلامنتها ضروری و لازم است. عدم استفاده از بستر گرم شونده استحکام سطح تماس لایهی نخست با صفحه چاپ را کاهش داده و باعث جدا شدن لبههای آن میگردد. اما فیلامنت PLA نیاز چندانی به بستر گرم شونده ندارد. با این وجود در صورتی که بستر گرم شونده را بر روی دمای 60 درجه سانتیگراد تنظیم کنید کیفیت چاپ افزایش مییابد.

اکریلونیتریل بوتادین استایرن (ABS) یکیدیگر از فیلامنتهایی است که کاربرد زیادی دارد. ABS رشته پلاستیکی مهندسی است که در عین ارزان بودن نسبت به بقیه متریالها جنس بسیار سفت و سختی دارد و نسبت به فیلامنت PLA منعطفتر است. همین امر باعث شده تا در استفاده نهایی و قرارگیری در کالاهای مصرفی نقش بیشتری داشته باشد. همچنین قادر است دمای بسیار بالا را تحمل کند. این دمای بالا هم برای قسمت داغ و هم برای بستر چاپگر لازم و ضروری است. همه انواع ABS در طول چاپ تاب بر میدارند و همین ویژگی باعث دقت ابعاد ضعیفتر میشود. دو اشکال مهم در این نوع فیلامنت وجود دارد. اولین مورد سمی بودن بخار ناشی از ABS در حین چاپ میباشد که برای حل این اشکال میتوان از تهویهی مناسب در نزدیکی پرینتر استفاده نمود. دومین مورد فرآیند چاپ آن است که معمولا در مقایسه با PLA کمی چالشیتر بوده است. انقباض (Shrinkage) این متریال در حین چاپ باعث شده تا نیاز به داشتن Heat Bed در پرینت آن الزامی شود. میتوان دمای صفحه گرم پرینتر را متناسب با مدل و توصیههای تولید کنندهی فیلامنت بر روی 60 الی 110 درجه سانتیگراد تنظیم نمود. دمای مناسب اکسترودر برای چاپ آن 220 الی 250 درجه میباشد.
ویژگیهای اصلی و اساسی این فیلامنت عبارتاند از:
-
دوام
مقاومت ABS بسیار بالاست و میتواند به راحتی در برابر ساییدن و یا پاره شدن دوام بیاورد. این رشته سفت و سخت میتواند در برابر ضربه نیز مقاومت خوبی از خود نشان دهد.
-
حلال بودن
ABS از میان مواد مصرفی در پرینترهای سه بعدی نمیتواند در آب حل شود؛ اما قابلیت حل شدن در حلالهای آلی را مانند استون، متیل اتیل کتون و استرها، دارد و میتوان از این خاصیت حلالی جهت پرداخت و پولیشن سازههای چاپ شده استفاده کرد.
مقایسه ABS و PLA
- مقاومت و انعطاف پذیری PLA در مقایسه با ABS کمتر است.
- معمولا PLA در بازار مواد مصرفی پرطرفدارتر از ABS است، زیرا استفاده از PLA راحتتر است و متنوعتر.
رشتههای الیاف کربن مواد کامپوزیتی هستند که با تزریق قطعات فیبر کربن در یک پایه پلیمری، شبیه رشتههای تزریق شده با فلز، اما در عوض با الیاف ریز، تشکیل میشوند. گاهی رشتههای پرینترهای سه بعدی را با افزودنیهای خاصی میسازند. این کار علاوه بر بهبود خواص مکانیکی فیلامنتها، ظاهر بهتر و زیباتری به آنها میبخشد. در حالی که مواد الیاف کربن واقعی دارای رشتههای فیبر پیوسته طولانی هستند که مقاومت مکانیکی را بهبود میبخشند، این رشتهها حاوی ذرات کوتاهی به قطر حدود ۰.۰۱ میلیمتر هستند.
اگرچه این برای بهبود مقاومت قطعات چاپ شده کافی است، به خاطر داشته باشید که چنین رشتههایی نمیتوانند با مواد واقعی مقایسه شوند. برخی از انواع فیلامنتهای پرینت سه بعدی معمولی را پیشتر بررسی کردیم که عبارتاند از: PETG، PLA یا ABS. در ادامه از ABS برای مثال زدن استفاده میکنیم. رشتههای پر شده با فیبر کربن نسبت به ترموپلاستیکهای پر نشده، خواص مکانیکی بهتری دارند. ابعاد آنها نیز ثابت است. این فیلامنتها مقاومت بالایی ندارند و به آسانی مسدود میشوند.
برخی از ویژگیهای کلیدی فیبر کربن شامل این موارد میشوند:
-
دوام
میتوان فیبر کربن را به فیلامنتهای ABS اضافه کرد و دوامشان را بهبود بخشید.
-
تاب برداشتن
افزودن فیبر کربن به ABS باعث کم شدن میزان تاب خوردگی آن میشود.
-
حلال بودن
ABS هایی که با فیبر کربن پر میشوند، قابلیت حل شدن در حلالهای آلی را مانند استون، متیل اتیل کتون و استرها دارند.
نتیجهگیری
پرینترهای سه بعدی با سه فناوری عمده کار میکنند که عبارتاند از تف جوشی لیزری، ذوب و استریولیتوگرافی. نحوه کار این دستگاهها در هر سه فناوری متفاوت است. همچنین مواد مصرفی در پرینترهای سه بعدی شامل فیلامنتهایی نظیر PLA و ABS میشوند. از مواد دیگر این دستگاهها میتوانیم به فلزات نیز اشاره کنیم. در این مقاله درمورد فناوریهای گوناگون پرینترهای سه بعدی و انواع فیلامنتهای آن مطالبی را بیان نمودیم.
































 چیست؟/what-goals are pursued-justification plan.webp)
 چیست؟/what areas- justification plan used.webp)
 چیست؟/what-methods of economic estimation in these plans.webp)
 چیست؟/explanatory plans-field of production of chemical raw materials.webp)













 and (SLM).webp)







 الکترونیکی/what-reason for using gold-electronic-boards.webp)
 الکترونیکی/how-extract gold-electronic boards.webp)
 الکترونیکی/plating-method.webp)
 الکترونیکی/chemicals-used-separate gold-electronic-boards.webp)